Bernhard
Peter
Bakteriengifte:
Das Choleratoxin
Bakterien sind Erzeuger hochpotenter Gifte. Manche Gifte aus Bakterien sind so potent, daß ein einziges Molekül ausreicht, um eine ganze Zelle lahmzulegen. Bakterien-Toxine sind viel wirkungsvoller als herkömmliche anorganische oder organische Gifte. Das Gift der Gifte, das mit der niedrigsten LD50, das Botulinum-Toxin, ist ebenfalls ein Bakteriengift. Aber auch die Erreger vieler Krankheiten wie Keuchhusten, Diphtherie oder Cholera wirken über ihre Toxine.
Warum sind
Bakteriengifte so wahnsinnig wirkungsvoll?
Bakterien haben eine
Reihe von Strategien entwickelt, um ihre Gifte so wirkungsvoll
wie möglich zu machen. Denn aufgrund des geringen Stauraumes in
Bakterien soll in jedem Molekül möglichst viel Wirkung stecken:
Strategie
Nr. 1:
Es handelt sich um
Proteine, Eiweiße, Polypeptide, Enzyme. Klassische Gifte wie
Zyankali wirken Molekül für Molekül. Für jede zerstörerische
Aktion wird ein neues Zyanidion benötigt. Nicht so die
Eiweißstrukturen: Sie wirken katalytisch, können ihre
schädliche Aktion immer wieder und wieder ausführen. Ein
einziges Molekül kann also die Chemie einer ganzen Zelle in
seinem Sinne verändern. Das Choleratoxin, einmal in eine Zelle
geschleust, ruht nicht eher, als bis die ganze Zellchemie
verändert ist und die Zelle zusammenbricht.
Strategie
Nr. 2:
Solche Bakteriengifte
wählen sich ihr Ziel. Einfach so alle Zellen befallen –
welch Verschwendung wertvoller Chemie wäre das. Nein, das Gift
soll natürlich bevorzugt dahin kommen, wo es den meisten Schaden
anrichtet! Was soll das Choleratoxin beispielsweise im Nagel der
linken Ringzehe, Blödsinn! In die Darmepithelzellen soll es
gelangen, am besten nur dahin, auf die Zellen der Oberflächen
des Dünndarmes, damit der Schaden am größten ist! Also muß
ein Zielerkennungsmechanismus her. Bakterielle Toxine bestehen
deshalb häufig aus mehreren Teilen, entweder separat wie beim
Milzbrand, oder miteinander verbunden wie beim Choleratoxin oder
beim Enterotoxin von Escherichia coli. Auch das Pertussis-Toxin und das
Diphtherie-Toxin bestehen aus zwei solchen Teilen, im
Pflanzenreich wird dieses Prinzip beim Ricin, dem Gift des Ricinus, analog
verwirklicht.
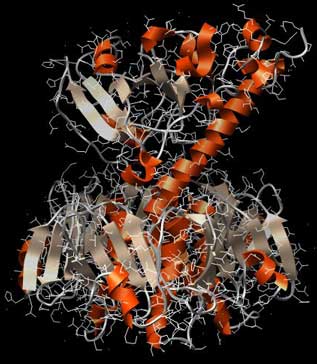
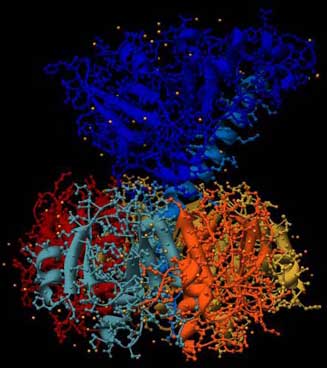
Die Abbildung zeigt den Aufbau des Choleratoxins von der Seite: Es ähnelt in der Form einem Stempel. Unten ein breiter Unterbau wie ein oben abgerundeter fünfeckiger Sockel, darüber eine schmale Wespentaille, dann oben der Stempelgriff mit seiner charakteristischen langen Alpha-Helix (besonders gut im linken Bild zu sehen). Im linken Bild ist die Sekundärstruktur hervorgehoben, im rechten Bild sind die einzelnen Aminosäureketten (5 im Sockel, zwei im Gift-Teil) farblich unterschieden.


Abb.: 3D-Raumstruktur von Choleratoxin, PDB-ID 1XTC, visualisiert mit Chimera. Seitenansicht, unten Erkennungsregion, oben eigentliches Gift, verschiedene graphische Darstellungen
Die „Stempelfläche“, der untere Teil, ist die Region, mit der das Gift an der Zielzelle andockt. Hier ist die Erkennungsregion für die Zielzellen. Der „Stempelgriff“ ist dagegen der Schadensbringer selbst, der hier im Huckepack obendrauf sitzt. Er ist der eigentliche Bösewicht, der aber nur dann in Aktion tritt, wenn die „Stempelfläche“ ihr Ziel erkennt, an der Zelle andockt und das Gift einschleust. Also haben wir es hier mit einer „Flaschenpost mit Adreßangabe“ zu tun. Das erklärt, warum die Gifte so effektiv sind.
Strategie
3:
Das Gift wird aktiv
in die Zielzelle hineinbefördert. Das ist wie ein Postversand
per Einschreiben mit Rückschein. Betrachten wir die
„Stempelplatte“ genauer: Der Blick von unten offenbart,
daß hier fünf mal die gleiche Proteinkette im Kreis angeordnet
ist, ein höchst symmetrisches Gebilde. Eine so schöne
Fünfer-Symmetrie findet sich übrigens auch noch beim Enterotoxin
von Escherichia coli.
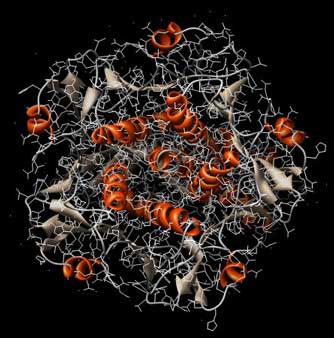
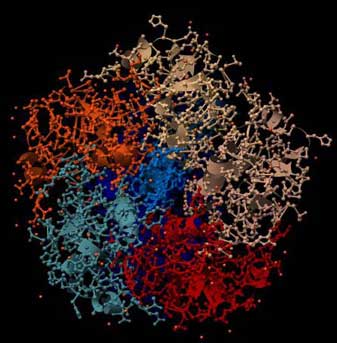
Abb.: 3D-Raumstruktur von Choleratoxin, PDB-ID 1XTC, visualisiert mit Chimera. Blick von unten auf die Erkennungsregion, verschiedene graphische Darstellungen. Im linken Bild ist die Sekundärstruktur hervorgehoben, im rechten Bild sind die einzelnen Aminosäureketten farblich unterschieden (5 im Sockel, zwei im Gift-Teil).
Diese Proteinketten binden an Kohlenhydratstrukturen auf der Zelloberfläche. Wenn die richtigen Zellen mit den richtigen Oberflächenstrukturen erkannt werden, wird die todbringende Fracht ausgeliefert, d.h. das Gift wird in die Zelle eingeschleust.
Wie wirkt
das Gift?
Einmal in die Zelle
eingeschleust, kann es losgehen: Ein einziges Molekül Gift
reicht aus, um die ganze Zelle lahmzulegen. Jedes G-Protein,
welches dem Toxin in der Zelle begegnet, wird gnadenlos
modifiziert: Es bekommt ein ADP-Molekül angehängt. Nun sind
G-Proteine nicht irgendwelche Langweiler in der Zelle, sondern
äußerst wichtig für die Nachrichtenübertragung im
Zell-System. Durch diese Veränderung werden die G-Proteine in
einen daueraktiven Zustand versetzt. Die Zelle wird mit Signalen
bombardiert. Als Folge dieses Chaos beginnt die Zelle, große
Mengen Wasser und Natriumionen nach außen zu befördern, bis sie
zugrunde geht. Dadurch kommt es den wäßrigen Durchfällen bis
hin zu lebensbedrohlicher Dehydrierung des Patienten - genannt Cholera.
Literatur:
http://www.rcsb.org/pdb/molecules/pdb69_1.html
http://www.rcsb.org/pdb/molecules/pdb69_2.html
http://www.rcsb.org/pdb/molecules/pdb69_3.html
R.-G. Zhang, D. L. Scott, M. L. Westbrook, S. Nance, B. D.
Spangler, G. G. Shipley and E. M. Westbrook. (1995) The
Three-Dimensional Crystal Structure of Cholera Toxin. Journal of
Molecular Biology 251, 563-573.
PDB-ID 1XTC, http://www.rcsb.org/pdb
Chemie der Gifte
Andere pharmazeutische Seiten
![]() Home
Home
©
Text, Graphik und Photos: Bernhard Peter 2005
Impressum