Bernhard
Peter
Insuline:
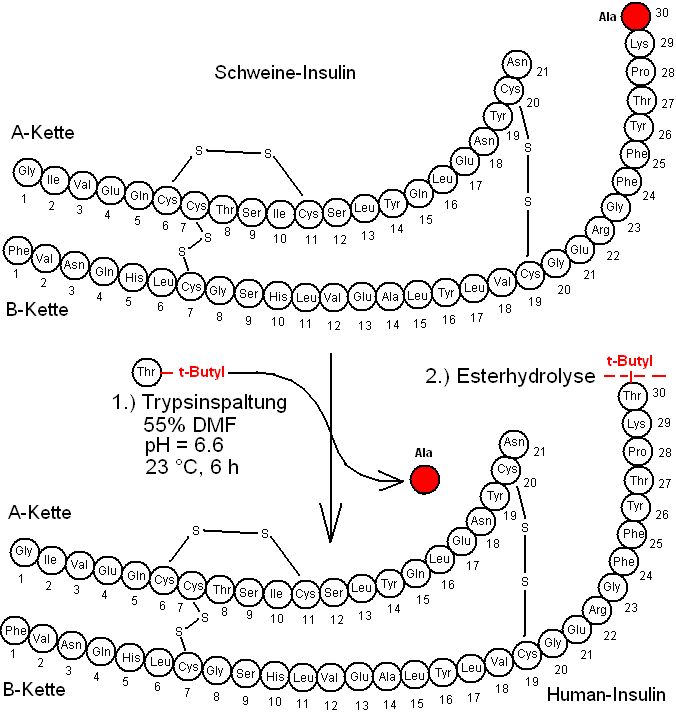
Umwandlung von Schweineinsulin in Human-Insulin
(Bitte besprechen Sie
im Zweifelfall Ihre Beschwerden und Maßnahmen mit einem Arzt
Ihres Vertrauens!)

Die Umwandlung ist chemisch einfach und leicht zu realisieren, weil nur eine Aminosäure ausgetauscht werden muß, die praktischerweise endständig ist: Das 30er-Alanin der B-Kette wird gegen Threonin ausgetauscht, welches mit einem tert-Butylester als Schutzgruppe versehen ist. Die Umwandlung wird durch die Endo-Protease Trypsin katalysiert. Trypsin schneidet immer nach basischen Aminosäuren, also hier nach Lysin (B29). Gefährdet ist auch Arginin (B22). Die Bedingungen werden bei dem von der Firma Höchst entwickelten Verfahren exakt so eingestellt, daß nur einmal, und zwar an der richtigen Stelle geschnitten wird. In einem zweiten Schritt wird die Schutzgruppe des Threonins (B30) abhydrolysiert, wodurch man biologisch aktives Humaninsulin erhält.
Dieses Verfahren hat den großen Vorteil, daß die Struktur mit Humaninsulin identisch ist. Wegen der begrenzten Verfügbarkeit von Schweine-Pankreas aus Schlachttieren ist das Verfahren aber nicht zur Deckung des immer größeren Insulin-Bedarfes geeignet.
Zurück zur Übersicht Diabetes
Andere pharmazeutische Seiten
![]() Home
Home
©
Text, Graphik und Photos: Bernhard Peter 2004
Impressum