Stephanie
Brach und Bernhard Peter
Die
Chemie der Weidenrinde
Stammpflanzen:
Salicis cortex ist die getrocknete
Rinde junger Zweige und stammt von verschiedenen Salix-Arten
(Salicaceae):[1, 3]
Die Art ist im DAB nicht vorgeschrieben, namentlich genannt werden S. purpurea und S. daphnoides, aber auch andere Weidenarten sind zugelassen, sofern sie den geforderten Salicingehalt von mindestens 1% aufweisen.
Die geforderten Gehalte erreicht nicht:[1]
Inhaltsstoffe von
Weidenrinde:
Charakteristische Inhaltsstoffe der
Salicaceae sind die Phenolheteroside, die einerseits Repellentien
gegen Pflanzenfresser und phytopathogene Organismen sind, zum
anderen für Spezialisten auch Signalstoffe zur Futterwahl sein
können (manche Chrysomeliden benötigen sogar Salicinderivate
zur Produktion ihres Abwehrstoffes Salicylaldehyd).[20]
Im einzelnen sind in Weidenrinde enthalten:
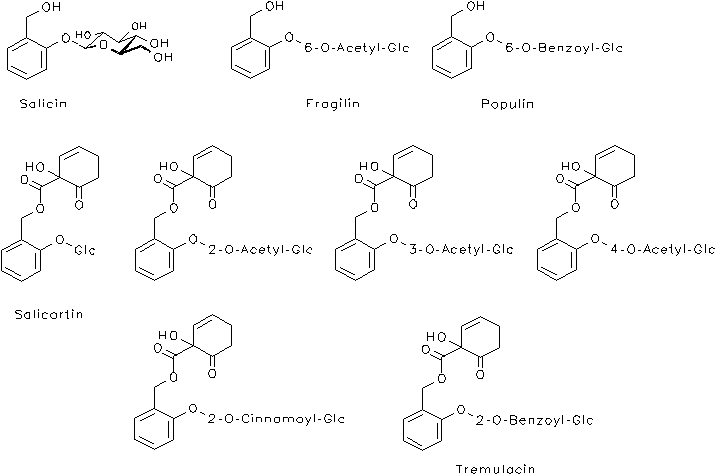
"Salicylate": 1.5 bis über 11%[1] bzw. bei den pharmazeutisch genutzten Weidenrinden 7-10%[2], bei Salix daphnoides ca. 3.9%, bei Salix purpurea ca. 3-8.5%, bei Salix alba ca. 0.5-1% (die Monographie der Kommission E fordert für Weidenrinde eine Dosierung, die einer täglichen Menge von 60-120 mg Salicin entspricht)[2], das sind Salicylalkoholderivate unterschiedlichster Zusammensetzung, u. a. Salicin (Saligenin-2-b-glucosid), seine 6'-O-Acylderivate Fragilin und Populin und dessen 2'-O-Acetylderivat, des weiteren Salicortin (1-Hydroxy-6-oxo-cyclohex-2-en-1-carbonsäureester des Salicins), seine 2'-O-, 3'-O- und 4'-O-Acylderivate, sein 2'-O-Benzoylderivat (Tremulacin) und sein 2'-O-Cinnamoylderivat.[1, 10] Weitere Verbindungen mit einem anderen Substitutionsmuster am aromatischen Ring sind Salireposid und Picein.[10]

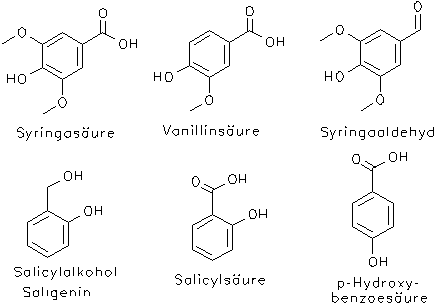
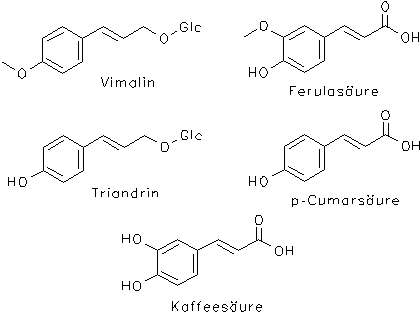
Weitere Inhaltsstoffe sind phenolische Verbindungen wie Triandrin, Vimalin und aromatische Alkohole, Aldehyde und Säuren wie u. a. Salicylalkohol (= Saligenin), Syringaaldehyd, Salicylsäure, p-Hydroxybenzoesäure, Kaffeesäure, Ferulasäure, p-Cumarsäure, Vanillinsäure und Syringasäure.[1, 2]
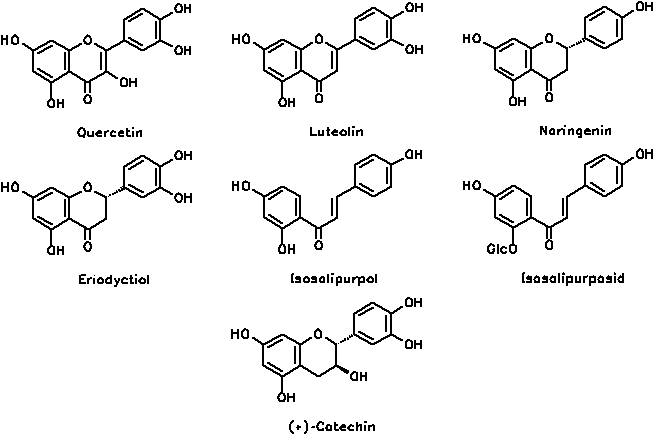
Flavonoide kommen ebenfalls in Weidenrinde vor: Quercetin- (Flavonol), Luteolin- (Flavon), Eriodictyol- (Flavanon), und Naringenin- (Flavanon) -Glycoside wurden gefunden, z. B. das Naringenin-7-O- und -5-O-Glycosid oder Isoquercitrin (= Quercetin-3-O-Glucosid). Die Flavanonole sind durch Ampelopsin repräsentiert, die Chalkone durch Isosalipurposid.[1, 2]
Weiterhin kommen (+)-Catechin und Gerbstoffe (vor allem Catechingerbstoffe) vor.[1, 2]
Pharmazeutische
Bedeutung und Verwendung von Weidenrinde:
Indikationen sind
Salicylalkohol und seine Glycoside selbst haben keine antiphlogistische Wirkung. Für die Wirkung sind vor allem Salicin und nach Abspaltung des/der Acylreste/s in Salicin übergehende Salicylate der Droge verantwortlich, die ein Prodrug der Salicylsäure darstellen und wie diese nach Transformation im Organismus antipyretisch, analgetisch, antiphlogistisch, antirheumatisch und antiseptisch wirken.[1]
Salicin wird nach peroraler Einnahme durch die Darmflora durch Glycosidspaltung in Saligenin (= Salicylalkohol) und Glucose gespalten. Saligenin wird resorbiert (Resorptionsrate über 86%), vor allem erheblich schneller als seine Vorstufen, und im Blut bzw. vor allem in der Leber zu Salicylsäure oxidiert. Die Ausscheidung im Harn erfolgt als Salicylursäure, daneben als Salicylglucuronid, Salicylsäure, Gentisinsäure, Gentisursäure und auch als unverändertes Saligenin.[1]
Wie die Acetylsalicylsäure ist auch die Salicylsäure ein Cyclooxygenase-Hemmstoff, der die Bildung der in den entzündlichen Geweben gebildeten Prostaglandine E1 und E2 erniedrigt, wobei die Thromboxan B2-Synthese jedoch schwächer beeinflußt wird. Salicylsäure kann das Enzym nicht durch Übertragung einer Acetylgruppe inhibieren, deshalb ist die Wirkung im Detail etwas anders als bei ASS.[7, 8, 9, 10] Die Droge kann deshalb auch nicht zur Aggregationshemmung der Blutplättchen eingesetzt werden. In vivo und in vitro kommt es zu unterschiedlichen Aktivitäten, wie nachfolgende Tabelle illustriert.[1]
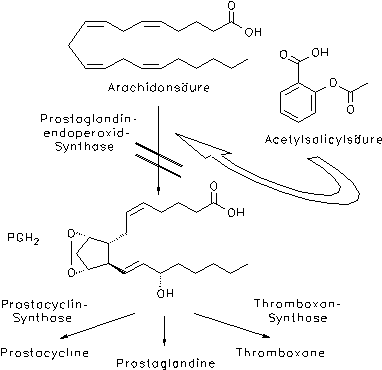
Schema: Wirkungsweise der Acetylsalicylsäure.
| Wirkung | ASS | Salicylsäure | Salicin |
| Analgetische bzw. antirheumatische Tagesdosis | 500 bis 3000 mg | therapeutisch obsolet | 60-120 mg 37-76 mg ASS |
| Hemmung der PG-Synthese in vivo | + |
+ |
+ |
| Hemmung der PG-Synthese im entzündlichen Gewebe | + |
+ |
+ |
| Hemmung der Cyclooxygenase in vitro | + |
- |
- |
| Hemmung der Thrombocyten-Aggregation | + |
- |
- |
Tabelle: Vergleich zwischen Acetylsalicylsäure, Salicylsäure und Salicin.[7]
Weidenrinde wird als Tee angewandt, dabei werden 55-100% der Salicylate extrahiert, abhängig vom Zerkleinerungsgrad und der Temperatur.[1] Nebenwirkungen sind möglicherweise gastrointestinale Beschwerden, die aber auf die Gerbstoffe der Droge zurückzuführen sind. Eine so hohe Konzentration, daß die Nebenwirken auf den Salicylaten beruhen, wir im Tee in der Regel nicht erreicht.
Sonstiges Vorkommen von
Salicylverbindungen (Salicylalkohole, -aldehyde und
-säuren):
Pappeln, Populus tremula und
andere Arten, Populi folium: Im wesentlichen gleiche
Inhaltsstoffe, aber noch höhere Gehalte: Während Weiden maximal
bis zu 10% Salicylalkohol-Derivate haben, können Pappeln bis zu
18% Salicylalkohol-Derivate enthalten.[3, 7]
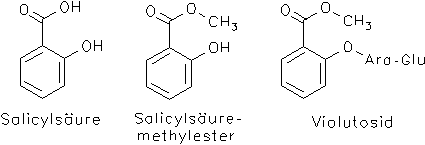
Stiefmütterchen, Violae tricoloris herba: An der Wirkung von Stiefmütterchenkraut beteiligt sind Salicylsäure (0.06-0.3%) und ihre Derivate Salicylsäuremethylester und Violutosid (= Violutosin, = Salicylsäuremethylester-glucosylarabinosid). Bei Verletzung der Zellen wird Violutosid enzymatisch zu Methylsalicylat gespalten und anschließend zur Salicylsäure verseift.[7, 12, 15]
Schlüsselblume, Primulae radix: In den Wurzeln von Primula veris und Primula elatior kommen Phenolglycoside vor,[7, 11, 14, 16] bevorzugt Primulaverin (= Primulaverosid, = 2-Hydroxy-5-methoxy-benzoesäuremethylester-2-(6b-xylosyl)-b-D-glucosid), bis zu 3%. Beim Trocknen entsteht durch enzymatische Hydrolyse das charakteristisch riechende 5-Methoxy-methylsalicylat. Ebenfalls in Wurzeln wurde das isomere Primverin (= 2-Hydroxy-4-methoxy-benzoesäuremethylester-2-(6b-xylosyl)-b-D-glucosid) gefunden.
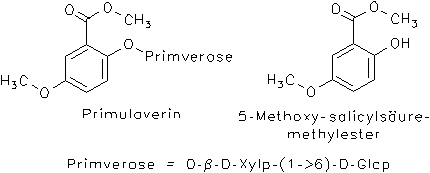
Mädesüß, Filipendula ulmaria, Spiraeae flos: Die Droge enthält ca. 0.3-0.5% einfache Phenolglycoside, vor allem Monotropitin (= Monotropitosid, = Gaultherin) und Spiraein (Primveroside des Salicylsäuremethylesters und des Salicylaldehyds). Während bei den Salicaceen bisher ausschließlich Derivate des Salicylalkohols gefunden wurden, ist das Spektrum der Salicylate bei Filipendula breiter. Aus diesen Verbindungen entsteht beim Trocknen und Lagern eine kleine Menge ätherischen Öles (0.2%), das zu ca. 70-75% aus Salicylaldehyd besteht, daneben kommen Salicylsäuremethylester (bis zu 20%), Phenylethylalkohol und Benzylalkohol vor.[13 (Achtung, im Wichtl sind Namen vertauscht!),7, 21]
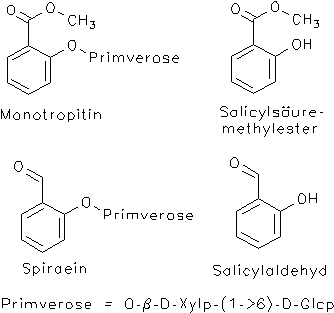
Wintergrün, Gaultheria procumbens: Aus dieser im Osten der USA beheimateten Ericaceae werden Wintergrünöl (Gaultheriae aetheroleum) und Wintergrün-Liniment (Linimentum gaultheriae compositum Helv VII) gewonnen. Hauptbestandteil des ätherischen Öles ist Methylsalicylat, das enzymatisch aus Monotropitin (Monotropitosid) entsteht.[18, 19]
Fichten- u. Buchenspargel, Monotropa hypopitys: Gehört zu den Monotropaceae, enthält Monotropitosid (= Monotropitin, = Glycosid aus Salicylsäuremethylester und Primverose).[19]
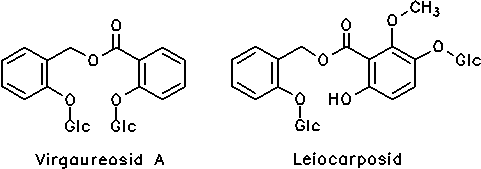
Goldrutenkraut, Solidago virgaurea (Asteraceae): Enthält Salicylalkohole, verestert mit Salicylsäure(derivaten), genauer Saligeninphenolcarbonsäureester-bisglycoside:[3, 17]
Literatur:
[1] M. Wichtl (Hrsg.), Teedrogen und Phytopharmaka, 3. Auflage, WVG, Stuttgart 1997, S. 517 ff.
[2] H. Wagner, Pharmazeutische Biologie 2, Drogen und ihre Inhaltsstoffe, 5. Auflage, Gustav Fischer Verlag, Stuttgart 1993, S.347.
[3] E. Teuscher, Biogene Arzneimittel, 5. Auflage, WVG, Stuttgart 1997, S. 177.
[4] K. K. Unger, E. Weber, Handbuch der HPLC, GIT-Verlag, Darmstadt 1995, S. 155.
[5] DAB 10, Monographie Weidenrinde, Grundlieferung 1991.
[6] JSK AK Ebel, Statistikprogramm für die analytische Chemie, Würzburg 1990.
[7] B. Meier, Schweiz. Apotheker-Zeitung, 25, 1988, 725.
[8] B. Meier, M. Liebi, Zeitschrift für Phytotherapie, 11, 1990, 50.
[9] B. Meier, Habilitationsschrift, ETH Zürich 1988, S. 88 ff.
[10] B. Meier, DAZ, 125, 1985, 341.
[11] E. Teuscher, Biogene Arzneimittel, 5. Auflage, WVG, Stuttgart 1997, S. 156.
[12] E. Teuscher, Biogene Arzneimittel, 5. Auflage, WVG, Stuttgart 1997, S. 176.
[13] M. Wichtl (Hrsg.), Teedrogen und Phytopharmaka, 3. Auflage, WVG, Stuttgart 1997, S. 566.
[14] M. Wichtl (Hrsg.), Teedrogen und Phytopharmaka, 3. Auflage, WVG, Stuttgart 1997, S. 458.
[15] M. Wichtl (Hrsg.), Teedrogen und Phytopharmaka, 3. Auflage, WVG, Stuttgart 1997, S. 620.
[16] H. Wagner, Pharmazeutische Biologie 2, Drogen und ihre Inhaltsstoffe, 5. Auflage, Gustav Fischer Verlag, Stuttgart 1993, S.157.
[17] H. Wagner, Pharmazeutische Biologie 2, Drogen und ihre Inhaltsstoffe, 5. Auflage, Gustav Fischer Verlag, Stuttgart 1993, S.348.
[18] E. Teuscher, Biogene Arzneimittel, 5. Auflage, WVG, Stuttgart 1997, S. 248.
[19] D. Frohne, U. Jensen, Systematik des Pflanzenreichs, 4. Auflage, Gustav Fischer Verlag, Stuttgart, Jena, New York, 1992, S. 236.
[20] D. Frohne, U. Jensen, Systematik des Pflanzenreichs, 4. Auflage, Gustav Fischer Verlag, Stuttgart, Jena, New York, 1992, S. 210.
[21] G. König, Vorlesung zu aromatischen Naturstoffen, Braunschweig 1997/8.
Phytochemie - Chemie der
Pflanzen
Andere pharmazeutische Seiten
![]() Home
Home
©
Text, Graphik und Photos: Bernhard Peter und Stephanie Brach 1999
Impressum