Bernhard
Peter
HIV
und AIDS: Ansätze für eine medikamentöse
Therapie
Medikamentöse
Optionen:
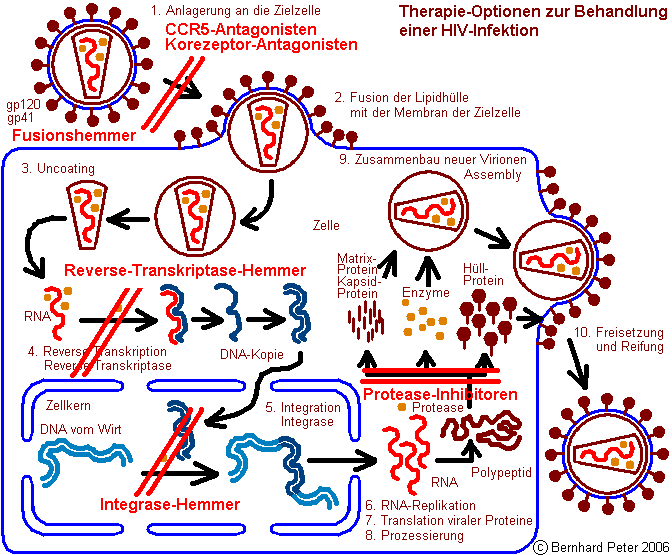
Es gibt
derzeit insgesamt 4
Wirkstoffklassen in der Therapie, die an drei unterschiedlichen
Stellen der Virusvermehrung eingreifen und jeweils einen
entscheidenden Schritt im Vermehrungszyklus hemmen. Weitere
Optionen sind in der Entwicklung. Für alle Medikamente gilt
gleichermaßen:

1a)
NRTI =
Nukleosidische Reverse-Transkriptase-Hemmer
Das sind
falsche Bausteine
(Nukleosid-Analoga sind ohne
Phosphatrest), die
vom Enzym Reverse Transkriptase nicht als solche erkannt und mit
den natürlichen Nukleosiden
verwechselt werden
und in die DNA-Kopie eingebaut werden. Dann rächt sich aber,
daß es der falsche Baustein war – die weitere
Synthese
hakt, es können keine weiteren Nukleotide angehängt
werden, es
gibt Strangbrüche, das Ergebnis ist Müll sowie eine
Reverse
Transkriptase, die nicht mehr funktioniert. Weil die Reverse
Transkriptase aber das entscheidende Schlüsselenzym ist,
welches
virale RNA in DNA umschreibt, kommt es zum Vermehrungsstop.
Beispiele: Zidovudin (März 1987), Lamivudin, Abacavir, Stavudin, Zalcitabin, Didanosin, Emtricitabin
Neuheiten in der Entwicklung: Elvucitabin (ACH-126,443), Reverset (DPC817), SPD754, Phoshazid (Prodrug von AZT), Racivir, Alovudin (MIV-310), Stampidin, Amdoxovir (DAPD)
1b)
NtRTI
= Nukleotidische Reverse-Transkriptase-Hemmer
Das sind
ebenfalls falsche
Bausteine (Nukleotid-Analoga besitzen
einen
Phosphatrest), die vom Enzym Reverse Transkriptase nicht als
solche erkannt werden und in die DNA-Kopie eingebaut werden.
Ansonsten wie oben.
Beispiele: Tenofovir (Februar 2002), Tenofovirdisoproxil
2)
NNRTI =
Nicht-Nukleosidische Reverse-Transkriptase-Hemmer
Diese
Stoffe binden an das
aktive Zentrum des Enzyms Reverse Transkriptase und hemmen es so.
Es handelt sich aber nicht um falsche Bausteine, sondern sie
verhindern die Bindung des Substrates. Eine Umschreibung in DNA
kann nicht erfolgen, die Virusvermehrung ist blockiert.
Beispiele: Delavirdin, Efavirenz, Nevirapin (Juni 1996)
Neuheiten in der Entwicklung: Etravirin (TMC125), Capravirin (AG1549, S-1153), Calanolide A, GW5634
3)
PI =
Protease-Hemmer
Diese
Stoffe hemmen die
Protease, das ist das Enzym, welches für den Schnitt der
hergestellten Vorläufer-Proteine und für den
Zusammenbau der
Viren aus den synthetisierten neuen Bausteinen verantwortlich
ist. Die HIV-Protease ist ein vom Virus codiertes Enzym, das
langkettige, viral gebildete Polypeptide in kleinere
Proteineinheiten spaltet, die dann zu infektiösen Virionen
zusammengebaut werden. Die Blockierung des Enzyms führt zu
unreifen, nicht-infektiösen Viren. Protease-Inhibitoren
verhindern deshalb neue Infektionszyklen. Dabei gibt es zwei
Sorten Wirkstoffe, die eine Sorte sind selber Peptide, die andere
nicht (Nicht-peptidische Protease-Hemmer).
Im Detail ist das noch ein wenig differenzierter: Die HIV-Protease ist eine Aspartylprotease, wie auch z. B. das Pepsin oder das Renin. Das bedeutet, daß sich im aktiven Zentrum zwei Asparaginsäuren befinden. Die HIV-Protease ist ein Homo-Dimer und besteht aus zwei identischen Untereinheiten mit einem gemeinsamen aktiven Zentrum. Das aktive Zentrum befindet sich in einem zentralen Hohlraum, in die sich die zu spaltenden Polyeptidstränge hineinlegen, um dort Hydrolyse zu erfahren und dadurch gespalten zu werden. Die kompetitiven PI tun so, als ob sie die bevorzugte Schnittstelle wären und täuschen die Protease, die ihre Funktion dann nicht mehr ausführen kann.
Beispiele: Indinavir, Nelfinavir, Saquinavir (Dezember 1995), Lopinavir, Amprenavir (Prodrug: Fosamprenavir), Ritonavir, Atazanavir, Tipranavir (PNU-140690)
Neuheiten in der Entwicklung: TMC114 (nicht-peptidischer PI), GW640385X (VX-385), AG-001859, SM-309515
Geboosterte
Protease-Inhibitoren:
Die oben
genannten
Protease-Hemmer werden immer zusammen mit niedrig dosiertem
Ritonavir kombiniert, um die Plasmaspiegel zu erhöhen
(Pharmako-Enhancer). Das funktioniert, weil Ritonavir die
abbauenden Enzyme (Cytochrom P450) in der Leber hemmt. Denn
normalerweise ist durch die häufige Tabletteneinnahme die
Compliance schlecht. Durch den Booster-Effekt kann die Anzahl der
Tabletten und die Häufigkeit der Einnahme reduziert werden. Im
Handel sind Fix-Kombinationen.
Doppelt
geboosterte Protease-Inhibitoren:
Niedrig
dosiertes Ritonavir
kann auch die Blutspiegel von zwei PI gleichzeitig erhöhen.
Diese Strategie wird aber erst bei Patienten mit Resistenzen oder
bei Unverträglichkeiten gegenüber RTase-Hemmern
angewandt. Ein
idealer Partner für die doppelt geboosterte Therapie ist
Atazanavir zu Lopinavir/Ritonavir, weil es zu einem positiven
synergistischen Effekt kommt.
4)
Neu: FI
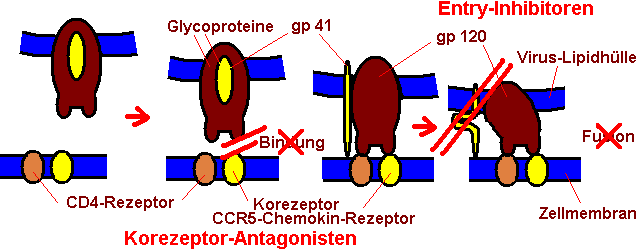
= Fusionshemmer, Entry-Inhibitor
Diese
Substanzen greifen
extrazellulär an und verhindern das Andocken der Viren und
damit
auch die Verschmelzung der Virionen mit der Wirtszelle. Wenn das
virale Glycoprotein gp120 an die zelleigenen Transmembranproteine
CD4 und CCR5 gebunden hat, dann sorgt das dadurch freigelegte
virale Glycoprotein gp41 dafür, daß sich Virus und
Zelle so
nahe kommen, daß die Fusion stattfindet, indem zwei
Abschnitte
von gp41 offengelegt werden, die sich miteinander verbinden. Erst
infolge dieser Konformationsänderung und Verkürzung
des
Abstandes kann die virale Membran mit der der Zielzelle
fusionieren. Genau hier greifen Fusionshemmer an: Sie blockieren
die Regionen des gp41-Proteins, so daß es sich nicht
verkürzen
kann. Vorteil: Dieses Konzept greift bereits vor dem Eindringen
des Virus in die Zelle und ist damit auch erfolgreich gegen
Virus-Stämme, die Resistenzen gegen intrazellulär
angreifende
Substanzen haben.
Beispiele: Enfuvirtid – ein Prototyp einer neuen Wirkstoffklasse (März 2003, „T20“, Peptid, 36 Aminosäuren, 106 Produktionsschritte, enorme Kosten, subcutane Injektion (lokale UAW), schlechte Compliance (Spitzen), nur bei ansonsten austherapierten Patienten, rasche Resistenzbildung).
Neuheiten in der Entwicklung:T-649, FP-21399
5)
Ganz
neu: CCR5-Antagonisten, Korezeptor-Antagonisten
Zum
Eindringen in die Zelle
muß das virale Glycoprotein an zwei Strukturen der Zelle
andocken, zum einen an den CD4-Rezeptor, zum anderen an den
Korezeptor CCR5, auch Chemokin-Rezeptor genannt. Ohne die
Erfüllung beider Bedingungen kann der Virus nicht mit der
Zelle
fusionieren. Eine Blockade des Chemokin-Rezeptors verhindert die
Infektion der Zelle. Neu an diesem Therapieansatz ist, daß
zum
ersten Mal nicht der Virus, sondern die menschliche Zelle Ziel
des Arzneistoffs ist.
Im Detail ist das noch ein bißchen komplizierter, denn es gibt noch einen zweiten möglichen Korezeptor, nämlich CXCR4. Viren mit einer CCR5-Präferenz werden R5-Viren genannt, solche mit einer CXCR4-Präferenz dagegen X4-Viren. 80% aller Viren sind R5-Viren. Je höher die CD4-Zell-Zahl und je niedriger die Viruslast ist, desto höher ist der Anteil der R5-Viren. X4-Viren werden wichtig in späteren Stadien des Infektionsverlaufes.
Beispiele für CCR5-Antagonisten: Prototyp ist die Substanz GW873140, derzeit in Phase II- und Phase III-Studien
Neuheiten in der Entwicklung: SCH-D (SCH-417690) Maraviroc (UK 427,857), „873,140“, TAK-220, Pro-140; AMD070 als CXCR4-Antagonist.
6)
Ganz
neu: Integrase-Hemmer
Die
Substanzen verhindern den
Einbau des DNA-Provirus in die Wirts-DNA. Damit kann sich der
Virus auch nicht mehr vermehren. Die menschliche Zelle besitzt
keine Integrase, insofern könnten die Hemmstoffe sehr selektiv
sein. Derzeit verläuft die Entwicklung jedoch eher schleppend.
Es bleibt abzuwarten, wie sich dieser Bereich entwickeln wird.
Beispiel: Prototyp ist die Substanz MK-0518 (Merck Sharp & Dohme), derzeit in Phase II-Studie. In einem Test verringerte die Substanz die Anzahl der RNA-Kopien im Blut um 98 %.
Neuheiten in der Entwicklung: S-1368, L-870812, L-870810, V-165
Literatur:
Deutsche
Apotheker-Zeitung, 17
(2004) S. 43-44
DAZ-Beilage Neue Arzneimittel 6 (1998) S. 44-47
Pharmazeutische Zeitung 27 (1997) 31-38
www.hiv.net 2005
Zurück
zur Übersicht HIV / AIDS
Andere pharmazeutische
Seiten
![]() Home
Home
![]()
©
Copyright Text, Graphik und Photos: Bernhard Peter 2006
Impressum